화2 ebs n제 에서 나온 질문 몇개드려용
게시글 주소: https://orbi.kr/0003720446
지식인에 올렸는데 답이 잘 안달려서 ㅠㅠ 오르비분들께 도움 구합니다 한개씩이라도 좋으니 댓글좀 달아주세요
문제에서 NaA와 BCl 두 결합물질이 있습니다

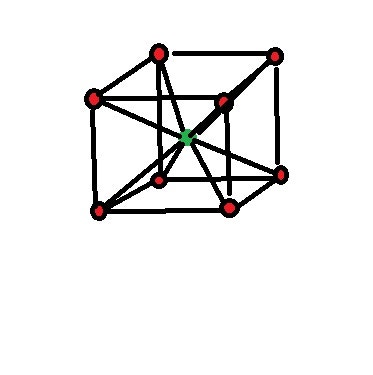
ㄱ. 두 화합물은 모두 단위 세포 속에 포함된 양이온과 음이온의 수가 같다.
라고 나오고 맞는 보기라는데요
두 가지 화합물의 양이온 수와 음이온 수가 1:1로 존재하는건 알겠는데
NaA(그림에선 NaCl)은 단위 격자속에 4:4 즉 1:1이지만 4개4개씩 존재하고
BCl 에서는 1:1 이며 한개한개로 존재하니
단위세포(격자)속 양이온과 음이온 수는 같지 않고 네배 차이나는것 아닌가요??
아니면 NaCl 저 여덟개의 사각형의 합이 단위세포가 아닌가요??
작은 사각형으로 치면 1/2개1/2개인데... 잘 이해가 안되네요
두번째 질문은요
다이아몬드와 흑연 사이관계인데
사실 궁금한것은 다른 조건이 같을때 '엔트로피 高 = 안정' 이 맞나요?
상식적으로 생각했을 때 엔트로피가 낮은 상태가 안정해보이잖아요...
엔트로피가 커진상태가 자발적인 상태이기때문에 안정하다는 건가요..?
근데 그 반대인 이유 설명해주세요ㅠㅠ
자투리 질문으로 이 문제에 C(s, 다이아몬드) + O2(g) → CO2(g)
반응이 STP에서 ΔG<0인 자발적 반응이라네요???
다이아몬드가 상온 공기중에서 자발적으로 산화되나요???
그럼 다이아몬드 반지도 시간이 지나면 CO2로 날라간다는소리...?
세번째 질문은 용액에서 계면 활성제입니다
화학2 교과서에 계면활성제가 어떤것인지 설명해놓지 않아서요
비누..같은게 계면활성제라고 알고는 있는데
계면활성제의 조건이 친수기와 소수기를 모두 포함한다 라고 하는데
왜 그래야하는지 계면활성제가뭔지 간단히설명부탁드려요
0 XDK (+0)
유익한 글을 읽었다면 작성자에게 XDK를 선물하세요.
-
특히국어
-
2025 n티켓 시즌1못 푸는건 아닌데.. 뭔가 수능에 안 나올 것 같은 문제들이 많아 보여요
-
오늘 ㄹㅈㄷ였음 0
나도 성인이 됐구나
-
왜 답이 1,4번인지 제발 설명좀 부탁드립니다 말이안돠는게이거
-
미친기분 시작편이 미친개념 전에 하는건가요..?
-
적성 안 맞으면 엄청 힘듭니다 이학년인데 전공이랑 너무 안 맞아서 편입할까 생각...
-
올해 수능보면 3
수학 영어는 1등급 나오겠지
-
6개월 달성 d-2
-
반수한다던 동기 1
술자리를 있는 거 없는 거 다 나가고 있다 뭐지 이녀석.
-
친애하고 존경하는 프란치스코 교황님 당신의 선종을 진심으로 슬퍼합니다 살아생전...
-
형님들 데학교시험에서가장어이업섯던시험문제 또는과제가무엇이었나요 약간변형해서말씀해주셔도조아용
-
고2 3모 24213입니다 수능때 목표는 화작,확통,한지,세지 해서...
-
가나 15분 나머지 20분썻는데 너무 많이쓰나
-
나 집 도착 일 끝!
-
어디서 야스를 한다고? 흐흫
-
뭐 가르치는건가요 그냥 sin세타를 세타를 치환하고 이런거 말하는거임요? 활꼴...
-
12 6평24수능25수능 아아...GOAT
-
자작시-그럼에도 0
처음 시를 쓸 때는 낙서에 불과했는데, 요즘은 그나마 구색이라도 갖춘거 같아서 마음이 기쁩니다
-
연속 다 맞은 거면 이제 노베 벗어난 거 맞져? 맞음 당신들은 내가 원하는 대답을 하면되
-
구라아님 광고글 아님
-
보통 컷 몇점이에요? 평백
-
[수학] 왜 나는 이 기출을 한 번도 풀어본 적이 없지?? 8
♤: 오늘 태어나서 존재 자체를 처음 알았네 ㄷㄷ ☆: 드릴드1에 이런 유형 개...
-
작수도그렇고 더프도그렇고 정답률은 100프론데 30분넘게 걸림… 맨날 독서...
-
난존나어려운거같은데
-
미친틀딱가형응시자들 18
-
숙취해소제 환/음료 12
뭐가 좋음
-
빌보드 95퍼가 의치한약수 갔다는데 이유가 있었구나
-
온라인 상에서도 착함이 느껴지는 사람들이 잇슴 그런 사람들 힘들어할때마다 속상함...
-
평가원 기준 높2~1컷은 돼야 소화가 가능하지 않나 싶은데
-
솔직히 압도적인 재능을 몇 번 봣던 본인으로써 재능,노력보단 부모의 케어가 더...
-
일단 나는 팬티 안입고 나가봄
-
스벅깊티로 교환하려고
-
편의점에서 구할 수 있는 마이너한 거요.
-
난 수험생때 가형틀딱킬러기출 전부 걸러서 몰랐는데 사설풀면서 내가 태어나서 처음보는...
-
현정훈 수특 0
현정훈 수특 관련한 컨텐츠도 있나요? 없으면 수특 사야할까요?
-
점수가 60후반에서 90대중반까지 진동을 미친듯이 침 사실 하방이 실력이라 생각해서...
-
사탐은 선지 구성 상 단순 5지선다건, ㄱ~ㄹ multiple choice건 모두...
-
좌석배정이 선착순인 현강인데 7시부터 시작하는데 보통 몇시쯤 들어가야 하나요? 동네...
-
살 좀 뺄까 싶어서 아침 거르는데 별 차이없는것 같은데 오히려 덜졸려서 좋음...
-
무물보 받음 7
선넘질도 ㄱㄴ 설거지하고 답변해줌
-
안녕하세요 '지구과학 최단기간 고정 1등급만들기' 저자 발로탱이입니다. 지난 1년간...
-
ㅈㄴ올만이야 그리고 아주옛날에 달팽이 핸드폰고리주는 음료수도 있었는데
-
개념이야 공부하면 되고 도표는 진짜 전국 1타 먹을듯 말그대로 그리고 사문은 안락사당함
-
이재명 '대북송금' 재판부 "객관적 사실로 공소사실 정리해달라" 5
검찰에 "법률적 평가 부적절…30쪽 이상 전제사실 필요 있나" 李측 "수사보고서...
-
드디어찾았다 1




















































네 일단 1번의 경우 가장 중요하면서도 많이 혼동하는 부분인데요
여러가지 설명방법이 있습니다만
첫번째 방법은, 우선 '단위 격자'라는 것이 저 꼭지점 부분의 구 8개를 전부다 포함하는게 아니라는것을 이해하는것이 중요해요
그렇게 되면 이웃하는 단위 격자들끼리 겹치는 부분이 생기겠죠?
결국 단위격자는 그 꼭지점 부분의 구 중에서, 안쪽 부분 즉 1/8부분만 해당됩니다
그게 8개 있으므로 곱하기 8하면 1이 되지요
2. 엔트로피가 낮은 상태에서 높은 상태로 되려고 하잖아요
즉 엔트로피가 낮으면 엔트로피가 증가할려고 애를 씁니다
그러니 불안정하다고 표현하구요
물론 구조상 무질서도가 증가하니까 '불안정'하다고 생각하실수있습니다
그러나 '불안정'의 개념은 구조상 뒤섞인게 아니고, 어떤 변화를 하려고 애를 쓰냐는 것이죠
예를들어 젠가를 쌓아놓으면 엎어지려고 하겠죠
하지만 뒤섞어놓으면 어지럽고 무질서하지만 다른 변화가 일어나지 않아요
아마 엔탈피와 헷갈리시는것 같네요
엔탈피는 낮을수록 안정하거든요
다이아몬드는 잘모르겠네요
3. 우선 계면활성제의 정의는 표면장력을 낮추는 물질입니다.
경계면, 물과 다른 물질 사이의 경계면을 활성, 즉 흐물흐물하게 한다는거죠
표면장력은 아시다시피 물분자 끼리 서로 끌어당기는 힘입니다.
물분자 뿐만아니라 극성인 분자도 끌어당깁니다
그러므로 극성인 물질은 물에 잘 녹아요
그러나 무극성인 물질은 물에 잘 녹지 않습니다
물에 녹는 다는 개념은 단순히 물에 섞이는것이 아니고
각 분자나 이온덩어리가 쪼개져서 물분자 사이사이로 들어가야 한다는 것입니다 (눈에 보이지 않게 되죠)
그러나 물은 자기들끼리 끌어당기고 무극성분자를 냅두므로, 녹질않습니다.
비누의 친수기는 물과 이웃하려고 하죠. 그리고 소수기는 물을 싫어하고 기름을 좋아합니다
그렇기 때문에 얘가 일종의 캡슐 역할을 합니다
소수기가 무극성 물질과 친하므로 얘를 감싸서 캡슐 역할을 합니다
캡슐 역할을 하면서 동시에 원래 있던 덩어리를 쪼개게 되지요
친수기가 있으므로 캡슐로 싼상태에서 다른 물 분자사이를 자유롭게 다닐수있어요
만약에 소수기만 있다면 캡슐로 싼다고 해도 소수성 물질들끼리만 뭉치게 될것입니다
친수기가 함께 있으므로 물에 녹아 자유롭게 떠다닐수있어요
정말 상세한 답변 진짜 감사드려요 이해가 확실히 가네요 그런김에 한개더 질문해도 될까요?
HBr 과 HI의 쌍극자 힘을 비교하는 문젠데요
우선 그래프에서 HBr의 끓는 점이 HI에보다 훨씬 낮다고 주어졌구요
ㄱ. HBR은 HI보다 쌍극자 사이 인력이 약하다
라는 보기가 틀렸다고 설명하네요
설명은 전기음성도가 Br > I 이기 때문에 쌍극자 사이의 인력은 HBr이 HI보다 크다 라는 설명인데
전기음성도 부분은 이해가 갑니다 전자껍질이 적을수록, 또 주기율표에서 오른쪽으로 갈수록 커지는 것이니까요
그런데 쌍극자-쌍극자 힘은 분산력까지 고려해야하는 것 아닌가요?
HBr에서 브로민이 수소의 전자를 더 세게 당겨서 대전되는 힘은 HI보다 강하지만
HI는 그것은 커버하고도 남을만큼의 분산력이 더 작용하기때문에 쌍극자-쌍극자힘이 강하고, 결과적으로 분자사이 인력이 증가해서 끓는점이 높아진것 아닌가요??
그럼에도 불구하고 왜 HBr의 쌍극자 사이 인력이 HI보다 큰지 잘모르겠습니다 ㅠㅠ
정확히 어떤 부분에 의문이 생기신지 잘 모르겠네요
제가 생각하는것이 맞을지는 모르지만 말씀드리자면
님 말씀대로 분산력은 막대한 영향을 미쳐요. 그렇기 때문에 끓는점이 HCl그러나 분산력이 크다고 쌍극자 사이의 인력이 강해지는 것은 아니에요
쌍극자 사이의 인력은 철저하게 쌍극자 모멘트의 크기, 즉 전하량과 거리의 곱에 비례합니다
왜냐하면 쌍극자 사이의 인력이라는 용어 자체가 이미 존재하고 있는 쌍극자 사이의 인력만 가리키기 때문이에요
분산력은 아시다시피 순간적으로 유발되는 전하 사이의 힘을 말합니다.
2개를 구분해주셔야 해요
아 그러니까 반데르발스 포스 = 쌍극자 인력 + 분산력 이고 쌍극자 인력이 어떠한가 에 대해 물어볼땐 분산력을 고려할 필요가 없는 것이군요? 감사합니다 ㅎㅎ
다시풀다가 궁금점이 생겼는데.. 1번 답변해주신거요
NaCl은 음이온 :1/8 짜리 여덟개 1/2짜리 여섯개 =4 양이온 : 1/4짜리 12개 1짜리 한개 =4
BCl은 음이온: 1/8 짜리 여덟개 = 1 양이온 : 1짜리 1개 = 1
결국 4:4 와 1:1 비율말고 양적차이를 이해하지 못하겠네요 ㅠㅠ 어떻게 보아야되는거죠?