[무료 배포] 수능특강 독서 지문 총정리 입니다.
게시글 주소: https://orbi.kr/00074858590
안녕하세요, 성재T입니다.
수능이 다가오는 여러분을 위해 수특 독서 본문 핵심 내용을 블로그에 정리해 두었습니다.
: 주제 통합 [1~12], 과학 기술[1~12], 사회 문화 [1~13], 인문 예술 [1~13]
필요한 부분을 참고해 효율적으로 공부에 활용해 보세요.
다음 주에는 수능 완성 핵심 내용 정리를 올릴 예정입니다.
https://blog.naver.com/ksj_93_/224020230356
 (핵심 내용 정리 예시)
(핵심 내용 정리 예시).png?type=w1)
(가)
연료 전지는 연료의 화학 에너지를 전기 에너지로 직접 변환시켜 주는 발전 장치로, 열기관과 달리 효율이 높고 소음, 진동, 배기가스의 문제점이 적다는 장점이 있다. 〈그림〉은 가장 대표적인 연료 전지인 수소 연료 전지의 원리를 나타내는 개략도이다. 이 장치는 기본적으로 산화 극, 환원 극, 전해질, 그리고 전기 도선으로 구성되어 있다. ㉠수소 연료 전지에서는 수소와 산소가 결합하여 물을 생성하는 화학 반응이 일어나고, 그 과정에서 장치의 외부로 연결된 도선을 통하여 전자가 산화 극에서 환원 극으로 이동하면서 전류가 얻어진다. 이는 전기를 써서 물을 전기 분해하는 것과 정반대의 반응이다.
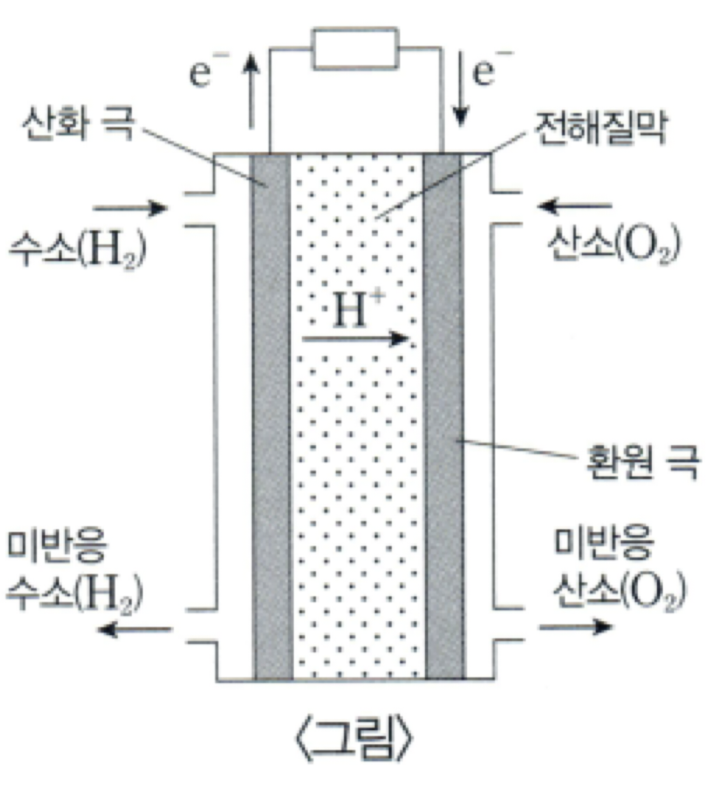

산화 극에서는 수소(H₂) 기체가 들어와 산화 극을 구성하는 탄소 물질의 표면에 있는 촉매의 도움으로 수소 이온과 전자로 분해된다. 수소 이온은 산화 극과 환원 극 사이에 있는 전해질을 통해 환원 극으로 이동하고 전자는 도선을 통해 환원 극으로 이동한다. 이때 전해질은 이온에 대해서는 전도성을 가지고 전자에 대해서는 전도성이 없다. 산화 극은 전기 화학에서 산화 반응이 일어나는 전극을 지칭하며 연료인 수소가 반응하는 전극이므로 연료 극이라 부르기도 한다. 산화 반응이란 어떤 분자가 전자 혹은 수소 원자를 잃거나 산소 원자를 얻는 반응을 일컫는다. 따라서 수소 연료 전지에서 산화 극 반응은 2H₂ → 4H⁺ + 4e¯와 같은 화학 반응식으로 나타낼 수 있다.
한편, 환원 극에는 공기 중의 산소(O₂) 기체가 반응에 참여한다. 만약 환원 극에 산소 기체를 공급하지 않고 수소 기체를 산화 극에만 공급한다면, 수소 기체가 전극에 흡착하여 원자 상태로 분리는 될 수 있지만 그렇게 생긴 수소 원자가 양이온과 전자로 분해되는 일은 생기지 않는다. 수소 원자가 전자를 내놓으면서 수소 양이온으로 바뀌려면 전자를 받는 성질이 강한 물질이 있어야 하는데, 그 역할을 하는 산소 기체가 환원 극에 공급되지 않기 때문이다. 또한, 산소 기체는 도선을 통해 환원 극에 도달한 전자뿐만 아니라 전해질을 통과하여 온 수소 이온을 받아 물로 전환된다. 즉 수소 연료 전지의 환원 극에서 일어나는 반응은 O₂+4H⁺ + 4e¯→ 2H₂O이다. 결국 수소 연료 전지에서 일어나는 전체 반응은 수소 기체와 산소 기체가 반응하여 물이 생성되는, 2H₂ + O₂ → 2H₂O의 반응이다. 이 반응의 역반응인 물의 전기 분해는 외부에서 전기 에너지를 가해 반응이 일어나지만, 수소 연료 전지의 반응은 자발적 반응이며 모든 연료 전지의 반응 또한 자발적이다.
[A]≪그렇다면 수소 연료 전지의 전체 반응은 왜 자발적으로 일어나는 것일까? 어떤 반응이 자발적으로 일어나기 위해서는 반응이 일어난 후의 물질의 에너지가 반응 전 물질의 에너지보다 작아서 안정된 상태가 되어야 한다. 이러한 준거가 되는 값이 깁스(Gibbs) 에너지 변화량인데 깁스 에너지 변화량은 출입한 반응열에서 엔트로피 변화와 온도의 곱을 뺀 값이다. 출입한 열은 발열 반응이면 (-) 부호를, 흡열 반응이면(+) 부호를 갖는다. 전체 반응을 반응물과 생성물 측면에서 살펴보면 2몰*의 수소 기[A] 체가 1몰의 산소 기체와 반응하여 2몰의 물이 만들어지는 반응이다. 엔트로피는 무질서한 정도를 의미한다. 따라서 액체보다는 자유로운 운동이 가능한 기체의 엔트로피가 크고 분자의 수가 많을수록 무질서하므로 전체 반응은 반응물과 생성물 측면에서 엔트로피가 감소하는 반응이다. 그런데 이 반응은 발열 반응이므로 온도에 의해서 깁스 에너지 변화의 부호가 결정된다. 즉 이 반응은 특정 온도 이하에서는 깁스 에너지 변화량이 음수가 되어 항상 자발적으로 일어나며 연료 전지의 작동 온도 범위는 이러한 특정 온도 이하에 있다.≫
*몰: 분자 6.02×10²³개.
(나)
연료 전지는 전해질의 종류에 따라 염기성 또는 산성 연료 전지로 나뉘고, 작동 온도에 따라 약 100캜에서 작동하는 저온, 약 200캜에서 작동하는 중온, 약 1,000캜 이상에서 작동하는 ㉡고온 연료 전지로 나뉜다. 일반적으로 연료 전지의 작동 온도는 전해질에 따라서 결정된다. 가령 전해질로 고분자 물질을 사용하는 연료 전지의 경우 전해질은 산성 물질이 사용되며 작동 온도는 저온이어야 한다. 반면 세라믹* 물질인 고체 산화물을 전해질로 사용하는 경우에는 이온 전도도가 저온에서는 매우 낮으므로 고온에서 작동시켜야 한다.
작동 온도에 따른 분류법 이외에도 연료 공급 방식에 따라 연료 전지를 구분하는 방법도 있다. ㉢직접 연료 전지란 탑재한 원료를 바로 산화 극에 공급하여 연료 전지를 구동하는 연료 전지를 말한다. 수소를 탑재하여 이를 연료로 공급해서 연료 전지를 작동하는 방법도 있고 메탄올이나 에탄올 같은 탄화수소를 연료로 산화 극에 공급하는 경우도 이에 해당한다. 이 경우 작동 온도는 저온이며 고분자 물질이 전해질로 쓰인다. 간접 연료 전지란 메탄올과 같은 연료를 탑재하고 메탄올을 수소로 전환하는 개질기*를 통해 수소를 얻고 이를 공급하여 작동하는 연료 전지를 일컫는다.
자동차의 동력원으로 연료 전지를 사용하는 경우, 수소 기체 저장 탱크를 차량에 탑재하여 운행하는 방법이 가장 보편적이다. 그러나 수소 기체는 저장의 어려움, 판매망 구축의 미비, 수소 저장 탱크의 안전성 등이 문제가 된다. 이와 같은 이유로 메탄올을 이용한 연료 전지가 자동차용 연료 전지로 부각되고 있다. 이때 개질기를 자동차에 탑재하고 메탄올을 연료로 사용할 수 있다. 이에 비해 직접 연료 전지인 직접 메탄올 연료 전지(DMFC)는 개질기를 사용하지 않고 직접 메탄올을 연료 극에 공급하는 연료 전지를 뜻한다. DMFC의 산화 극 반응은 메탄올이 물과 반응하고 이산화 탄소로 전환되어 수소 이온과 전자를 내는 반응이며, 환원 극 반응은 산소가 양극에서 발생한 수소 이온과 전자와 반응하여 물이 되는 반응이다. 따라서 DMFC의 전체 반응은 메탄올과 산소가 반응하여 이산화 탄소와 물을 생성하는 반응이므로 DMFC는 친환경 자동차 동력원의 역할을 할 수 있을 것이다.
*세라믹 : 고온에서 구워 만든 금속이 아닌 무기질 고체 재료.
*개질기: 메탄올과 같은 탄화수소를 물과 반응시켜 수소로 전환하는 장치.
[본문 정리]
(가)
[1문단] 연료 전지의 정의와 수소 연료 전지의 개요
*주요 내용:
1) 연료 전지의 기본 개념:
① 연료의 화학 에너지를 전기 에너지로 직접 변환하는 발전 장치
② 열기관 대비 높은 효율, 낮은 소음, 진동, 배기가스 문제
2) 수소 연료 전지의 특징:
- 가장 대표적인 연료 전지
- 산화극, 환원극, 전해질, 전기 도선으로 구성
- 수소와 산소 결합하여 물 생성 반응 이용
- 산화극에서 환원극으로 전자 이동하며 전류 발생
- 물의 전기 분해와 정반대 반응
*문단 요약: 연료 전지는 연료의 화학 에너지를 전기 에너지로 변환하는 장치로, 특히 수소 연료 전지는 수소와 산소의 반응을 이용해 전기를 생산하며 효율성과 친환경성이 높음.
*쉽게 요약: 연료 전지는 화학 에너지를 바로 전기로 바꾸는 좋은 발전 장치인데, 그중 수소 연료 전지는 수소랑 산소를 이용해서 물 만들면서 전기를 만들어내는 대표적인 예시야.
[2문단] 수소 연료 전지의 산화극 반응 상세 설명
*주요 내용:
1) 산화극의 역할 및 반응:
① 수소 기체 유입 및 촉매 표면에서 수소 이온과 전자로 분해
② 수소 이온은 전해질 통해 환원극으로 이동
③ 전자는 도선을 통해 환원극으로 이동
2) 산화 반응의 정의 및 수소 연료 전지 산화극 반응식:
- 산화 반응: 분자가 전자 또는 수소 원자를 잃거나 산소 원자를 얻는 반응
- 수소 연료 전지 산화극 반응식: 2H₂ → 4H⁺ + 4e¯
3) 산화극의 다른 이름:
- 연료극 (연료인 수소가 반응하는 전극이므로)
*문단 요약: 수소 연료 전지의 산화극에서는 수소 기체가 촉매에 의해 수소 이온과 전자로 분해되는 산화 반응이 일어나며, 생성된 수소 이온과 전자는 각각 다른 경로를 통해 환원극으로 이동함.
*쉽게 요약: 수소 연료 전지 산화극에서는 수소가 쪼개져서 수소 이온이랑 전자가 되는데, 이때 전자는 전선 타고 환원극으로 가고, 수소 이온은 전해질이라는 길을 통해서 환원극으로 가.
[3문단] 수소 연료 전지읭환원극 반응 및 전체 반응 설명
*주요 내용:
1) 환원극의 역할 및 반응 조건:
① 산소 기체 공급 필수 (수소 원자가 수소 양이온으로 분해되기 위해 필요)
② 산소 기체가 전자와 수소 이온을 받아 물로 전환
2) 환원 반응 및 환원극 반응식:
- 환원극 반응식: O₂+4H⁺ + 4e¯ → 2H₂O
3) 수소 연료 전지의 전체 반응:
- 전체 반응식: 2H₂ + O₂ → 2H₂O
- 자발적 반응 (물의 전기 분해의 역반응, 연료 전지 반응은 자발적)
*문단 요약: 수소 연료 전지의 환원극에서는 산소 기체가 공급되어 전자를 받아 물로 환원되는 반응이 일어나며, 전체적으로는 수소와 산소가 반응하여 물이 생성되는 자발적 반응임.
*쉽게 요약: 수소 연료 전지 환원극에서는 산소가 전자를 받아서 물이 되고, 결국 수소 연료 전지 전체적으로 보면 수소랑 산소가 만나서 물이 되는 반응이 스스로 일어나는 거야.
[4문단] 수소 연료 전지 전체 반응의 자발성 원인 분석
*주요 내용:
1) 반응의 자발성 조건:
- 반응 후 물질의 에너지가 반응 전 물질의 에너지보다 작아야 함 (안정된 상태)
- 깁스 에너지 변화량(<0)이 자발성 판단 기준
2) 깁스 에너지 변화량 계산:
- 깁스 에너지 변화량 = (출입한 반응열) - (엔트로피 변화 × 온도)
- 발열 반응: 반응열 (-) 부호, 흡열 반응: 반응열 (+) 부호
3) 수소 연료 전지 반응의 특징과 자발성:
- 반응물: 2몰 수소 기체 + 1몰 산소 기체 → 생성물: 2몰 물
- 엔트로피 감소 반응 (기체 → 액체, 분자 수 감소)
- 발열 반응
- 특정 온도 이하에서 깁스 에너지 변화량 음수 → 자발적 반응
- 연료 전지 작동 온도 범위는 자발적 반응이 가능한 특정 온도 이하
*문단 요약: 수소 연료 전지 전체 반응이 자발적으로 일어나는 이유는 발열 반응이면서 엔트로피 감소 반응이지만, 발열 반응의 영향으로 특정 온도 이하에서 깁스 에너지 변화량이 음수가 되어 자발성을 확보하기 때문임.
*쉽게 요약: 수소 연료 전지 반응은 스스로 일어나는데, 왜냐하면 반응하면서 열이 나오고, 깁스 에너지 변화량이라는 값이 0보다 작아지기 때문이야. 깁스 에너지 변화량은 복잡하지만 쉽게 말하면 반응이 스스로 일어날지 말지를 알려주는 값이라고 생각하면 돼.
*전체 요약:
수소 연료 전지는 수소와 산소의 화학 반응을 통해 전기를 생산하는 효율적인 발전 장치이며, 산화극에서 수소의 산화 반응, 환원극에서 산소의 환원 반응이 일어나 물을 생성한다. 이 전체 반응은 발열 반응이며 특정 온도 조건 하에서 자발적으로 진행되어 연료 전지의 작동 원리가 된다.
(나)
[1문단] 연료 전지의 다양한 분류 기준과 작동 온도
*주요 내용:
1) 연료 전지의 분류 기준:
① 전해질의 종류:
- 염기성 연료 전지
- 산성 연료 전지
② 작동 온도:
- 저온 연료 전지 (약 100캜)
- 중온 연료 전지 (약 200캜)
- 고온 연료 전지 (약 1,000캜 이상)
2) 작동 온도 결정 요인:
- 전해질의 종류에 따라 결정됨
3) 전해질과 작동 온도 예시:
① 고분자 물질 전해질:
- 특징: 산성 물질 사용
- 작동 온도: 저온
② 세라믹 물질 (고체 산화물) 전해질:
- 특징: 이온 전도도가 저온에서 낮음
- 작동 온도: 고온
*문단 요약: 연료 전지는 전해질 종류와 작동 온도에 따라 분류되며, 작동 온도는 주로 전해질에 의해 결정되고, 고분자 물질은 저온, 세라믹 물질은 고온에서 작동함
*쉽게 요약: 연료 전지는 전해질에 따라 염기성, 산성으로 나뉘고, 온도에 따라 저온, 중온, 고온으로 나뉘는데, 전해질 종류가 작동 온도를 정해
[2문단] 연료 공급 방식에 따른 연료 전지 분류와 특징
*주요 내용:
1) 연료 전지의 연료 공급 방식에 따른 분류:
① 직접 연료 전지:
- 정의: 탑재 연료를 산화 극에 직접 공급하여 구동
- 연료 예시: 수소, 메탄올, 에탄올
- 작동 온도: 저온
- 전해질: 고분자 물질
② 간접 연료 전지:
- 정의: 탑재 연료를 개질기를 통해 수소로 전환 후 공급
- 연료 예시: 메탄올
2) 자동차용 연료 전지 예시 및 문제점:
① 수소 연료 전지:
- 연료 공급 방식: 수소 기체 저장 탱크 탑재
- 문제점: 저장 어려움, 판매망 미비, 저장 탱크 안전성
3) 메탄올 연료 전지의 부각:
- 이유: 수소 연료 전지의 문제점 대안
- 연료 공급 방식: 개질기 탑재 후 메탄올 연료 사용 가능
*문단 요약: 연료 전지는 연료 공급 방식에 따라 직접 연료 전지와 간접 연료 전지로 나뉘며, 직접 연료 전지는 연료를 바로 공급하고, 간접 연료 전지는 개질기를 통해 수소를 만들어 공급하며, 자동차 연료 전지로는 수소의 문제점 때문에 메탄올 연료 전지가 주목받음
*쉽게 요약: 연료를 바로 쓰면 직접 연료 전지, 바꿔서 쓰면 간접 연료 전지인데, 자동차 연료 전지는 수소 대신 메탄올 쓰는 게 좋아지고 있어
[3문단] 직접 메탄올 연료 전지(DMFC)의 특징 및 반응
*주요 내용:
1) 직접 메탄올 연료 전지 (DMFC):
- 정의: 개질기 없이 메탄올을 연료 극에 직접 공급하는 직접 연료 전지
2) DMFC의 반응:
① 산화 극 반응:
- 반응물: 메탄올, 물
- 생성물: 이산화 탄소, 수소 이온, 전자
- 반응식 (일반화): 메탄올 + 물 → 이산화 탄소 + 수소 이온 + 전자
② 환원 극 반응:
- 반응물: 산소, 수소 이온, 전자
- 생성물: 물
- 반응식 (일반화): 산소 + 수소 이온 + 전자 → 물
③ 전체 반응:
- 반응물: 메탄올, 산소
- 생성물: 이산화 탄소, 물
- 반응식: 메탄올 + 산소 → 이산화 탄소 + 물
3) DMFC의 친환경성:
- 이유: 전체 반응 생성물이 이산화 탄소와 물이므로 친환경 자동차 동력원으로 적합
*문단 요약: 직접 메탄올 연료 전지(DMFC)는 메탄올을 직접 연료로 사용하며, 산화 극에서 메탄올과 물이 반응하여 이산화 탄소, 수소 이온, 전자를 생성하고 환원 극에서 산소와 수소 이온, 전자가 반응하여 물을 생성하며, 전체 반응은 메탄올과 산소로부터 이산화 탄소와 물을 생성하는 친환경 반응임
*쉽게 요약: DMFC는 메탄올을 바로 쓰는 연료 전지인데, 반응 결과로 이산화탄소랑 물만 나와서 환경에 좋은 자동차 연료로 쓸 수 있어
*전체 요약:
연료 전지는 전해질과 작동 온도, 연료 공급 방식에 따라 다양하게 분류되며, 자동차 연료 전지 분야에서는 수소 연료 전지의 한계점을 극복하기 위해 메탄올 연료 전지가 대안으로 떠오르고 있다. 특히 직접 메탄올 연료 전지(DMFC)는 개질기 없이 메탄올을 직접 사용하여 친환경적인 자동차 동력원으로 주목받고 있다. DMFC는 메탄올과 산소의 반응을 통해 전기 에너지를 생산하며, 부산물로 물과 이산화탄소만을 배출하는 친환경적인 시스템이다.
[본문 심화독해]
(가)
[key] 1) 글의 중심내용 정리
- 연료 전지는 연료의 화학 에너지를 전기로 직접 바꾸는 장치로 효율이 높고 환경 문제도 적다.
- 수소 연료 전지는 수소와 산소의 화학 반응을 이용해 전기를 생산하며, 산화 극과 환원 극에서 각각 산화 반응과 환원 반응이 일어난다.
- 산화 극에서는 수소가 수소 이온과 전자로 분해되고, 환원 극에서는 산소, 수소 이온, 전자가 결합하여 물이 생성된다.
- 연료 전지의 전체 반응은 수소와 산소가 반응하여 물이 되는 자발적 반응이며, 이는 깁스 에너지 변화로 설명할 수 있다.
- 연료 전지는 전해질 종류, 작동 온도, 연료 공급 방식에 따라 다양하게 분류되며, 자동차 동력원 등 친환경 에너지 기술로 주목받고 있다.
[key] 2) 글의 내용 쉽게 다시 이해
우연료 전지는 건전지처럼 화학 에너지를 바로 전기로 바꿔주는 기계인데, 일반 발전소보다 훨씬 깔끔하고 효율도 좋아. 특히 수소 연료 전지는 수소랑 산소가 만나서 물이 되는 반응을 이용하는데, 신기하게 이 과정에서 전기가 쫙 나와.
- 산화 극(연료 극): 수소가 들어와서 분해되는 곳이야. 마치 레고 블록이 분해되듯이 수소 분자가 수소 이온이랑 전자로 나뉘어. 수소 이온은 전해질이라는 길을 따라서 환원 극으로 가고, 전자는 전선 길을 따라 환원 극으로 가.
- 환원 극: 공기 중 산소가 들어오는 곳이야. 환원 극에서는 산소가 전선 타고 온 전자랑, 전해질 길로 온 수소 이온을 만나서 물이 돼. 마치 분해된 레고 블록들이 다시 합쳐져서 새로운 작품이 되는 것과 같아.
결국 수소 연료 전지는 수소랑 산소가 만나 물이 되는 과정에서 전기를 만들어내는 장치인데, 이 반응은 스스로 알아서 일어나. 신기하지? 마치 높은 곳에 있는 물이 아래로 저절로 흘러내려가듯이 말이야. 이런 이유로 연료 전지는 미래 에너지 기술로 아주 중요하게 생각되고 있어.
[key] 3) 지문을 읽는 Key (비교 분석 및 예시)
▷수소 연료 전지 vs. 물 전기 분해
- 수소 연료 전지: 수소 + 산소 → 물 (전기 생산, 자발적 반응). 마치 물레방아가 물의 힘으로 저절로 돌아가면서 곡식을 빻는 것처럼, 화학 반응이 스스로 일어나 전기를 만들어내는 거야.
- 물 전기 분해: 물 → 수소 + 산소 (전기 소모, 비자발적 반응). 마치 물을 거꾸로 높은 곳으로 끌어올리려면 펌프질(전기 에너지 투입)이 필요한 것처럼, 외부에서 에너지를 넣어줘야 반응이 일어나는 거야.
▷산화 극 vs. 환원 극
- 산화 극 (연료 극): 수소 ‘산화’ 반응이 일어나는 곳. ‘산화’는 전자를 잃는 반응이야. 마치 은행에서 돈(전자)을 인출하는 것처럼, 수소가 전자를 내놓고 수소 이온이 돼. (예시: 2H₂ → 4H⁺ + 4e⁻)
- 환원 극: 산소 ‘환원’ 반응이 일어나는 곳. ‘환원’은 전자를 얻는 반응이야. 마치 은행에 돈(전자)을 예금하는 것처럼, 산소가 전자를 받아서 물이 돼. (예시: O₂ + 4H⁺ + 4e⁻ → 2H₂O)
▷자발적 반응 vs. 비자발적 반응 (깁스 에너지)
- 자발적 반응: 스스로 알아서 일어나는 반응 (예: 높은 곳에서 공이 굴러 내려오는 현상). 깁스 에너지 변화량이 ‘-’ 값이어서 안정된 상태로 가려는 성질 때문에 일어나. 수소 연료 전지 반응이 자발적 반응에 해당해.
- 비자발적 반응: 외부에서 에너지를 공급해줘야 일어나는 반응 (예: 언덕 아래에 있는 공을 다시 언덕 위로 굴려 올리는 현상). 깁스 에너지 변화량이 ‘+’ 값이어서 불안정한 상태로 가려는 성질 때문에 외부 에너지 없이는 일어나지 않아. 물 전기 분해 반응이 비자발적 반응에 해당해.
▷연료 전지의 장점
- 높은 효율: 열기관처럼 여러 단계를 거치지 않고 화학 에너지를 바로 전기로 바꾸니까 효율이 좋아. 마치 자전거를 타면 페달을 밟는 힘이 바로 바퀴를 굴리는 힘으로 전달되는 것처럼, 에너지 손실이 적어.
- 친환경적: 배기가스 대신 물만 나오니까 환경 오염 걱정이 없어. 마치 전기 자동차처럼 매연 없이 깨끗하게 운전할 수 있는 것과 같아.
- 저소음, 저진동: 조용하고 진동이 적어서 쾌적해. 마치 도서관처럼 조용한 환경에서 발전기를 돌릴 수 있는 것과 같아.
이처럼 연료 전지는 화학 반응과 에너지 변화의 원리를 이용한 똑똑한 발전 장치이며, 다양한 분야에서 활용될 미래 에너지 기술이라는 것을 기억하면 좋겠어.
(나)
[key] 1) 글의 중심내용 정리
- 연료 전지는 전해질의 종류에 따라 염기성 또는 산성 연료 전지로, 작동 온도에 따라 저온, 중온, 고온 연료 전지로 나뉜다.
- 연료 전지의 작동 온도는 주로 전해질의 종류에 의해 결정되며, 고분자 전해질은 저온, 고체 산화물 전해질은 고온에서 작동한다.
- 연료 공급 방식에 따라 직접 연료 전지와 간접 연료 전지로 구분되며, 직접 연료 전지는 연료를 바로 공급하고, 간접 연료 전지는 개질기를 통해 수소를 얻어 공급한다.
- 자동차 연료 전지 분야에서 수소 저장 방식의 어려움으로 인해 메탄올 연료 전지가 주목받고 있으며, 개질기를 사용하는 방식과 직접 메탄올 연료 전지 방식이 있다.
- 직접 메탄올 연료 전지(DMFC)는 메탄올을 직접 연료로 사용하여 이산화 탄소와 물을 생성하는 친환경적인 발전 방식이다.
[key] 2) 글의 내용 쉽게 다시 이해
연료 전지는 마치 건전지처럼 전기를 만드는 장치인데, 사용하는 물질과 작동 방식에 따라 여러 종류가 있어. 우선, 건전지 안의 액체 종류에 따라 염기성이나 산성으로 나뉘고, 작동하는 온도에 따라서도 나뉘어. 아주 낮은 온도에서 작동하는 것, 중간 온도에서 작동하는 것, 아주 높은 온도에서 작동하는 것이 있지. 온도는 건전지 안의 액체 종류에 따라 주로 결정돼.
연료를 넣는 방식에 따라서도 달라지는데, '직접 연료 전지'는 연료를 그냥 바로 넣어 쓰는 거고, '간접 연료 전지'는 연료를 다른 장치로 먼저 바꿔서 수소라는 기체를 만든 다음에 쓰는 거야. 마치 밥을 바로 먹는 거랑, 쌀을 밥솥에 넣어서 밥을 지어 먹는 것과 같은 차이지.
자동차에 연료 전지를 쓸 때, 수소 기체를 차에 싣고 다니는 방법이 흔한데, 수소는 보관하기 어렵고 위험할 수도 있어서 메탄올이라는 액체를 쓰는 연료 전지가 인기가 많아지고 있어. 메탄올을 쓸 때도 두 가지 방법이 있는데, 하나는 메탄올을 바로 연료 전지에 넣는 '직접 메탄올 연료 전지'이고, 다른 하나는 메탄올을 먼저 수소로 바꿔서 연료 전지에 넣는 방식이야. '직접 메탄올 연료 전지'는 메탄올을 쓰면 이산화 탄소랑 물이 나오니까 환경에도 좋대.
[key] 3) 지문을 읽는 Key (비교 분석 및 예시)
- 연료 전지 분류 기준: 전해질 vs. 작동 온도 vs. 연료 공급 방식
- 전해질에 따른 분류: 염기성 연료 전지 vs. 산성 연료 전지
- 건전지 속 액체가 염기성이면 염기성 연료 전지, 산성이면 산성 연료 전지라고 불러. 마치 김치찌개 종류가 김치에 따라 묵은지 김치찌개, 총각김치 김치찌개 등으로 나뉘는 것과 같아.
- 작동 온도에 따른 분류: 저온 연료 전지 vs. 중온 연료 전지 vs. 고온 연료 전지
- 작동 온도에 따라 연료 전지를 나누는 거야. 100캜 근처에서 작동하면 저온, 200캜 근처면 중온, 1000캜 이상이면 고온 연료 전지라고 해. 마치 물 온도를 차갑게, 미지근하게, 뜨겁게 나누는 것처럼 온도를 기준으로 분류하는 거지.
- 연료 공급 방식에 따른 분류: 직접 연료 전지 vs. 간접 연료 전지
- 연료를 바로 쓰느냐, 아니면 바꿔서 쓰느냐에 따라 나뉘어. 연료를 바로 연료 전지에 넣으면 직접 연료 전지, 연료를 개질기라는 장치로 수소로 바꾼 다음에 연료 전지에 넣으면 간접 연료 전지야. 마치 라면을 끓일 때 면을 바로 넣느냐(직접), 스프를 먼저 끓인 후 면을 넣느냐(간접)의 차이와 비슷해.
- 직접 연료 전지 vs. 간접 연료 전지 (메탄올 연료 전지 예시)
- 직접 메탄올 연료 전지 (DMFC): 메탄올을 연료 극에 직접 공급
- 장점: 구조 간단, 개질기 불필요
- 단점: 메탄올 효율 낮음, 이산화 탄소 발생
- 예시: 휴대용 전자기기, 소형 자동차 등에 사용 가능. 마치 즉석밥처럼 바로 데워 먹을 수 있는 편리함.
- 간접 연료 전지 (개질기 사용 메탄올 연료 전지): 메탄올을 개질기로 수소로 변환 후 연료 극에 공급
- 장점: 수소 연료 전지의 높은 효율 활용 가능
- 단점: 개질기 필요, 시스템 복잡
- 예시: 수소 연료 자동차처럼 높은 출력이 필요한 곳에 적합. 마치 쌀을 밥솥에 지어 밥을 해먹는 것처럼 정성이 더 들어가지만 더 좋은 밥맛을 얻는 것과 같아.
- 연료 종류: 수소 vs. 메탄올 (자동차 연료 전지 측면)
- 수소 연료 전지: 연료로 수소 기체 사용
- 장점: 높은 에너지 효율, 부산물은 물뿐
- 단점: 수소 저장 및 운반 어려움, 안전 문제, 인프라 부족
- 예시: 현재 수소 연료 자동차. 마치 깨끗한 물이지만 보관하고 옮기기가 어려운 유리병과 같아.
- 메탄올 연료 전지: 연료로 메탄올 액체 사용
- 장점: 액체 연료로 저장 및 운반 용이, 기존 연료 인프라 활용 가능, DMFC로 시스템 간소화 가능
- 단점: 수소 연료 전지보다 효율 낮음 (DMFC), 이산화 탄소 발생 (DMFC, 개질기 사용 모두)
- 예시: 메탄올 연료 자동차, DMFC 자동차. 마치 휘발유처럼 보관과 사용이 편리하지만, 연소 시 매연이 나오는 자동차와 비슷해 (DMFC는 이산화탄소 발생).
0 XDK (+0)
유익한 글을 읽었다면 작성자에게 XDK를 선물하세요.
-
지2 왤케 재밌어보이지
-
ㅈㄱㄴ
-
덴지마냥사지 절단돼도 ㅇㅇ
-
대체로 원래 하던 사람들임?
-
서프 목동 대기 107번인데 빠지나요...
-
한달안에 풀 수 있는 수학 N제 추천해 주실수 있나요? 4
수특 수완보다 N제푸는게 수학실력에 더 도움이 될 거같은데 혹시 추천해주실만한 N제 있을까요?
-
공통만 틀렸는데 1가능인건가요?
-
내년 수능 준비 중이고 현재 중경외시 인문계열 재학 중입니다. 수학 처음부터...
-
트럼프 "미국 밖에서 만든 모든 영화에 100% 관세 부과" 4
"미국의 영화제작사업, 다른 나라들에 도둑맞았다" 주장 (워싱턴=연합뉴스) 김동현...
-
혹시 이과면 사문 정법 경제중에서 뭐가 좋나용?
-
의대들 목 딱대라
-
대학잘가고싶당 3
인정하면댓글
-
이 또한 군자(君子)답지 아니한가?
-
반수 괜히 햇나
-
후.. 10
드뎌 집이군
-
gg 희망버리기
-
어느정도 맞아야해요?
-
할말하않
-
백분위98이 결국 80으로 떨어지네...
-
뭐지 계속 오류뜨는데
-
고사장은 시대 건물이 아닌가요? 점심은 도시락인가요?
-
아니 서프 0
나 열한시에 들어갔는데 새로고침 걍 하지말걸 ㅜ 저번에 바로잡았는데 이번에 대기네……. 다시하게해줘
-
진짜 냉정하게 3
언매 87 미적 88 지구 42면 작년에비해 훨씬널럴한건 맞다노아님 ?
-
어 ㅅㅂ 2
서프 신청해야하는데
-
고1 9였나10모옄ㅅ나 3등급떳음
-
빨간 날에 해서 현역이들 몰렸나 보네...니넨 학평도 보잖아 현역이들아ㅠ
-
형은 서프 성공 0
서프!
-
언매 3틀 -6 공통 3틍 -8 이에여
-
서프볼때 1
도시락도 챙겨가야하나요??
-
하 미녀만 찍도록 법을 개정해야함
-
어렵게 나오면 표점+가산으로 서울대 메디컬이나 높공 가면 되고 쉽게 나오면...
-
ㅋㅋㅋ
-
진짜 이름이 좃같은 모고라니..
-
언매 중간2 기하 중간2 영 1 경제 2 사문 1이면 연고대 어문계열도 힘들까요?...
-
https://youtube.com/shorts/ZKAE_3CNzo0?si=FoTy0...
-
어좃모 후기!!! 15
내 안녕하세용 부엉이입니다 어좃모를 풀어봤어요 ㅈ됐습니다 진짜 ㅈ됐습니다! 어떻게...
-
미적 진짜 왜이리 많이 하는지.. 나는 절대 미적 감당 불가 였는데 ㅋㅋ.. 내년...
-
11411이 고경이 안되네 심지어 저건 393점인데 컷이 413점이라네
-
6모 백분위 언매 확통 영어 사문 지1 51 78 3(75) 89 58 9모 백분위...
-
이새끼존나웃기네 2
책에 흥미를 가지는것도 유전 운도 유전 백종원이 따로없노
-
수학 실모요 3
여러시즌이 있잖아요 한 선생님꺼 풀로 풀기보단 여러쌤들거 풀어보고싶은데 하나만...
-
작수 미적 1틀
-
국어 사설실모와 6,9평 점수차가 너무커요 이런분 있으신가요 10
07현역 6평 화작 82점 틀린건 기억안나고 9평 화작 87점이고 독서 3개...
-
”오르“만 봐도 반응하네
-
흠)ㅋㅋ
-
다 뒤졌다 ㅋㅋ
-
꺄룰 0
서프 신청 완료 시대인재에서 뵈어요














































첫번째 댓글의 주인공이 되어보세요.